Besondere musikalische Begabungen und Fähigkeiten
Umfassender Musiker:innen-Datenpool unserer Quer- und Längsschnittstudien
Auf der Basis eines langjährig projektübergreifend aufgebauten Datenpools mit musikalischen Laien und professionellen Musiker:innen ist es möglich geworden, die enorme Variabilität neuro-auditorischer Profile aufzuzeigen. In Zukunft sollen gezielte Metanalysen aus unserem Datenpool mit rund 1200 Musiker:innen-Datensätzen durchgeführt werden. Dieser Datenpool beruht sowohl auf einmaligen hörakustischen, neuroanatomischen (MRT) und/oder neurophysiologischen (MEG) Messungen (Querschnitt) als auch auf Verlaufsdaten über längere Zeiträume (Längsschnitt). Aufgrund des großen Stichprobenumfangs lassen sich anhand interessierender Merkmale, wie Lebensalter (~15 bis 85 Jahre), Beruf, besondere auditive Fähigkeiten und Defizite etc., gezielt Substichproben zusammenstellen. Bisher untersuchten wir spezielle Fähigkeiten, Begabungen und Präferenzen von musizierenden Kindern und Jugendlichen, sowie von erwachsenen Amateur- und Profimusiker:innen für verschiedene gespielte Instrumente und Stimmlagen im Zusammenhang mit den zugrundeliegenden neuroanatomischen und neurophysiologischen Merkmalen.
Eigene methodische Neuentwicklungen zur neurowissenschaftlichen Untersuchung besonderer musikalischer Fähigkeiten
Zur Erfassung der neuroanatomischen und neurofunktionellen (f)MRT- Daten entwickelten wir auf der Basis der Software Brain Voyager QX (Prof. Rainer Goebel, Brain Innovation, Maastricht) und Brain Electromagnetic Source Analysis (BESA GmbH, Prof. M. Scherg, Gräfelfing) spezielle Auswerteprotokolle zur individuellen Segmentierung, 3D-Rekonstruktion, Morphometrie, Analyse der kortikalen Dicke sowie zur Aktivierung auditorischer Subareale und Quellenanalyse auditorisch evozierter Felder (Schneider et al., 2002, 2005; Seither-Preisler et al., 2014; Benner et al., 2017, 2023; Turker et al. 2017; Zoellner et al., 2019). Die Verfahren sind inzwischen standardisiert und wurden wegen ihres innovativen Potenzials prämiert (Brain Voyager Design Award, 2006). Obwohl die Methoden zunächst zur Erforschung des auditorischen Kortex entwickelt wurden, sind sie prinzipiell auf das gesamte Gehirn anwendbar und eröffnen faszinierende neue Möglichkeiten zur Analyse individueller Besonderheiten. Denn sie erlauben nicht nur gruppenspezifische Vergleiche, sondern auch Analysen von neuronalen Netzwerken, um neben auditiven auch multisensorische Verarbeitungsprozesse zu untersuchen.
Neuro-auditorische Profile von Musiker:innen
Ein wesentlicher Aspekt unserer Forschung fokussiert auf die erhebliche interindividuelle Variabilität in der elementaren Hörverarbeitung und auditiven Mustererkennung. So variiert die Frequenzunterschiedsschwelle, d.h. die Fähigkeit, die Tonhöhe zweier nacheinander gespielter Töne zu unterscheiden, von typischerweise 2-3 Halbtönen bei legasthenen Kindern bis hin zu < 1 Cent (< 1/100 Halbton) bei außergewöhnlich begabten Musiker:innen (Schneider et al., 2018).
Besonders interessiert uns, wie solche auditiven Fähigkeiten mit musikalischen Kompetenzen zusammenhängen und ob diese besser durch stabile Neuromarker im Gehirn (Begabung) oder durch musikalische Förderung (lernbedingte Plastizität) erklärt werden können (vgl. Forschungsfeld „Entwicklung auditiver und musikalischer Fähigkeiten“). Ein Vergleich der entsprechenden Quer- und Längsschnittdaten sowie eine Gegenüberstellung der neuroauditorischen Profile von Menschen mit auditiven Verarbeitungs- und Wahrnehmungsstörungen, normalhörenden musikalischen Laien und verschiedenen Instrumentalist:innen und Sänger:innen liefern hier wertvolle Hinweise. Aufgrund von genetischen Studien und eigenen neurowissenschaftlichen Forschungsergebnissen gehen wir davon aus, dass sowohl Anlage als auch Umwelt einen wesentlichen Beitrag zum Merkmal „Musikalität“ leisten, wobei die Veranlagung einen etwas größeren Einfluss zu haben scheint (Schneider, P. & Seither-Preisler, A., 2015). Dies hat auch Implikationen für die Musikpädagogik und die therapeutische Praxis. Einerseits geht es um das Erkennen und gezielte Fördern besonderer musikalischer Begabungen. Andererseits lässt sich durch Kenntnis des neuroplastischen Potenzials die Erfolgswahrscheinlichkeit für musikalische Trainingsprogramme sowie für musik- und hörtherapeutischer Interventionen bei auditiven Verarbeitungs- und Wahrnehmungsstörungen besser einschätzen.
Unsere Studien haben gezeigt, dass sich die neuroanatomischen Merkmale des Hörkortex interindividuell stark voneinander unterscheiden, intraindividuell aber von der Kindheit bis ins Erwachsenenalter weitestgehend stabil bleiben. Abb. 1 zeigt exemplarisch bei fünf Personen die anatomische Variabilität der Subareale des auditorischen Kortex (HG, PT, anteriorer supratemporaler Gyrus / aSTG), welche stark in Größe, Form und Rechts-Links-Asymmetrie variieren (Schneider et al., 2018). Dies wirkt sich auch unmittelbar auf die auditorischen Aktivierungsmuster dieser Areale aus (Wengenroth et al., 2014).
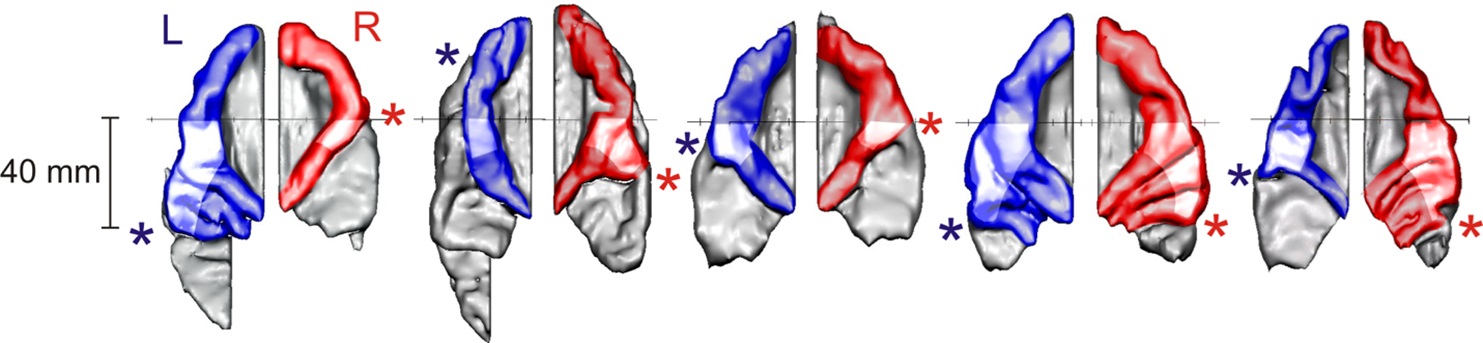
Fünf individuelle 3D-Rekonstruktionen auditorischer Kortizes; von links nach rechts: Schlagzeuger (25 J.), musikalisch begabtes Kind mit LRS (8 J.), Nichtmusikerin (9 J.), musikalisch hochbegabter Amateurmusiker (48 J.), Konzert-Organist (85 J.). Farbig (blau: links, rot: rechts): Heschlsche Querwindungen im Zentrum des auditorischen Kortex, grau: Planum temporale. * seitliches Ende des ersten vollständigen Heschl Sulcus, der die Heschlschen Querwindungen einschließlich potentieller Duplikaturen vom dahinter liegenden Planum temporale trennt.
Unsere langjährigen Arbeiten zeigen, dass ein direkter Zusammenhang zwischen der subjektiven Hörwahrnehmung einerseits und neuroanatomischen und -funktionellen Merkmalen andererseits besteht (Schneider et al., 2002, 2005, 2005a, 2023; Seither-Preisler et al. 2014).
Bezüglich der seltenen Fähigkeit, die Tonhöhe eines gehörten Klanges unmittelbar zu erkennen und zu benennen („absolutes Gehör“) wurde von uns erstmals ein rechtshemisphärisches neuronales Netzwerk identifiziert, welches die qualitative Sinneserfahrung repräsentiert, sowie eine Ko-Aktivierung des linkshemisphärischen Broca-Areas nachgewiesen, welches für das „Labeling“ der wahrgenommenen Tonhöhen in musikalischen Tonhöhenkategorien verantwortlich ist (Wengenroth & Schneider, 2014).
Auch hinsichtlich der Wahrnehmung harmonischer Klangspektren, wie sie typischerweise beim Singen und von den meisten Musikinstrumenten erzeugt werden, gibt es große individuelle Unterschiede. Harmonische Klänge sind einerseits durch ihre zeitliche Periodizität (Grundtonhöhe) und andererseits durch ihr Frequenzspektrum (Obertöne und die sich daraus ergebende Klangfarbe) charakterisiert. Welcher Aspekt die subjektive Wahrnehmung dominiert, hängt in starkem Maße von individuellen neuroanatomischen Merkmalen ab. Grundtonhörer:innen weisen meist ein höheres Volumen an grauer Substanz in der linken und Obertonhörer:innen in der rechten Heschlschen Querwindung auf, was sich auch in den dort generierten auditorisch evozierten Antworten abbildet (Schneider at al., 2005). Diese individuellen Unterschiede korrespondieren wiederum mit der Instrumentenpräferenz (Schneider & Wengenroth, 2009). So spielen Grundtonhörer:innen meist Instrumente, bei denen es auf eine hohe Präzision zeitlich fluktuierender Anteile ankommt (z.B. Schlaginstrumente, Gitarre, Klavier, Trompete). Obertonhörer:innen entscheiden sich hingegen meist für Instrumente, bei denen es auf feine Nuancen in der Klangfarbengestaltung ankommt, während die zeitliche Akzentuierung eine untergeordnete Rolle spielt (z.B. Orgel, Oboe, Klarinette, Horn, Cello). Dieses Muster wird vor dem Hintergrund verständlich, dass der linke Hörkortex auf die sequentielle Verarbeitung zeitlich schnell fluktuierender Information und der rechte Hörkortex auf die parallele Analyse spektraler Klanganteile spezialisiert ist (Schneider & Seither-Preisler, 2022, 2023). Diese Dichotomie hat auch ihre Entsprechung in der Sitzordnung des Symphonieorchesters, wo perkussive Instrumente und Soloinstrumente, die oft schnell und dynamisch gespielt werden, auf der linken und klangfarbenreiche Begleitinstrumente auf der rechten Seite zu finden sind. Letzteres spiegelt sich sogar in den individuellen Gehirnen der betreffenden Musiker:innen wider, wie sie von Peter Schneider beim Mannheimer Nationalorchester und beim Royal Liverpool Philharmonic Orchestra (RLPO) vermessen wurden (Schneider et al., 2005a; Abb. 2).
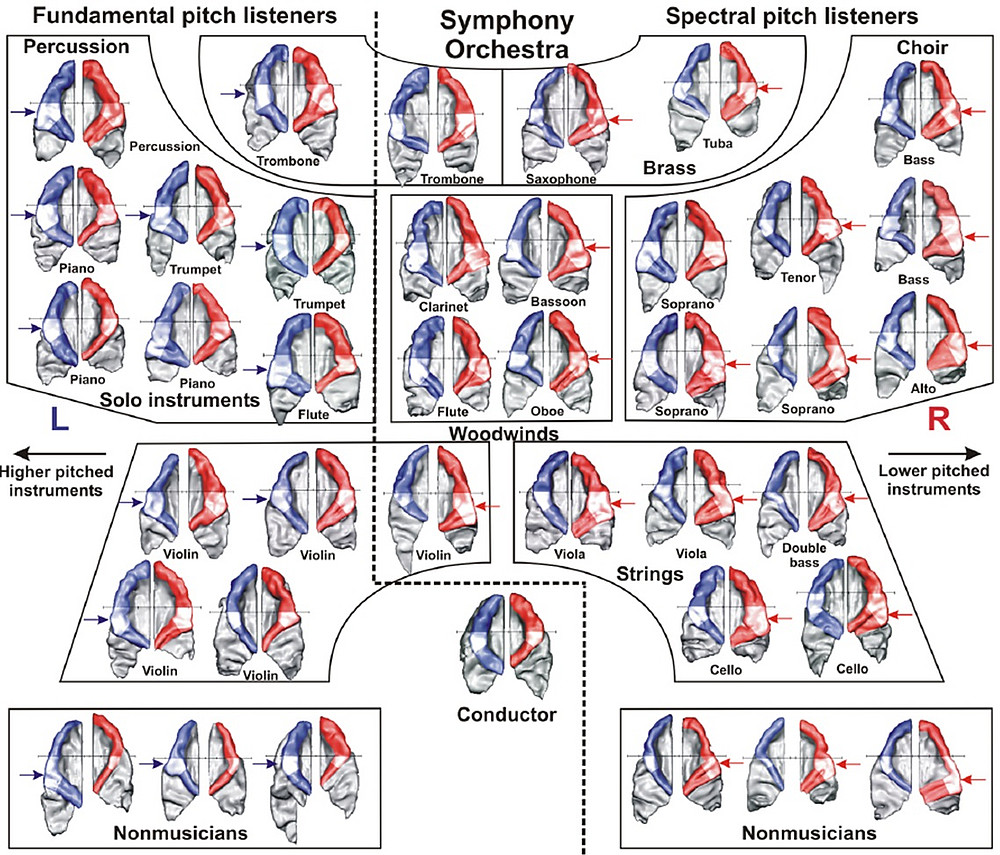
Auditorische Kortizes ausgesuchter Musiker:innen des Mannheimer Nationalorchesters und des Royal Liverpool Philharmonic Orchestra mit Angabe der gespielten Instrumente und ihrer Platzierung im Orchester. Weiß markiert ist das Volumen des für die Klangverarbeitung wesentlichen anterolateralen Teils der Heschlschen Querwindung in der rechten und linken Hemisphäre.
Die mit unterschiedlichen neurowissenschaftlichen und psychoakustischen Verfahren gewonnenen Daten lassen sich anschaulich zu einem individuellen neuro-auditorischen Gesamtprofil zusammenfassen. Abb. 3 zeigt am Beispiel einer Dirigentin ein solches Profil.
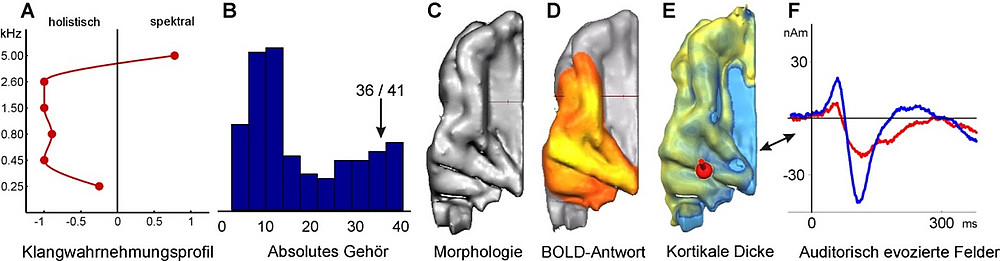
Abb. 3:
Neuro-auditorisches Gesamtprofil einer Dirigentin. (A) Klangwahrnehmungsprofil (Oberton-Grundtontest, Schneider et al., 2005), (B) graduelle Ausprägung des absoluten Gehörs (Wengenroth et al., 2014), (C) Morphologie des Hörkortex, (D) Funktionelle BOLD-Aktivierung beim Hören von Klängen, (E) Kortikale Dicke und Lokalisierung des MEG-Dipols (rote Kugel), (F) Zeitabhängigkeit der auditorisch evozierten Antworten der rechten (rote Linie) und linken (blaue Linie) Hemisphäre beim Hören von Instrumentalklängen. Die dargestellten individuellen Charakteristika erlauben u.a. Prognosen, welches Musikinstrument, welcher Musikstil und welche pädagogische Lernstrategie besonders gut geeignet sein könnten.
Bisher ist unerforscht, inwieweit eine derartige anatomische und funktionelle Variabilität auch in anderen Bereichen des Gehirns zu finden sein könnte. Unsere Pilotstudien weisen eindeutig in diese Richtung. Abb. 4 zeigt als Beispiel verschiedene hirnanatomische Merkmale eines musikalisch und kognitiv hochbegabten Jugendlichen. Dabei sind Korrespondenzen zwischen der individuellen Gyrierung visueller Subareale (Fig.3, A), dem Handknopf-Areal im präzentralen Gyrus (B) und dem auditorischen Kortex (C) erkennbar. Als übergreifendes Muster finden sich in diesem Fall diverse Multigyrierungen.
Abb. 4:
Beispiele für ein individuelles visuell – motorisch - auditorisches Profil eines hochbegabten Jugendlichen. (A) segmentierter visueller Kortex; farbig markiert ist der aufgeklappte Bereich zwischen Sulcus calcarinus und Sulcus parieto-occipitalis; (B) Segmentierter rechter Handknopf, Ansicht von hinten auf den präzentralen Gyrus; (C) Heschlsche Querwindungen, Aufsicht von oben.
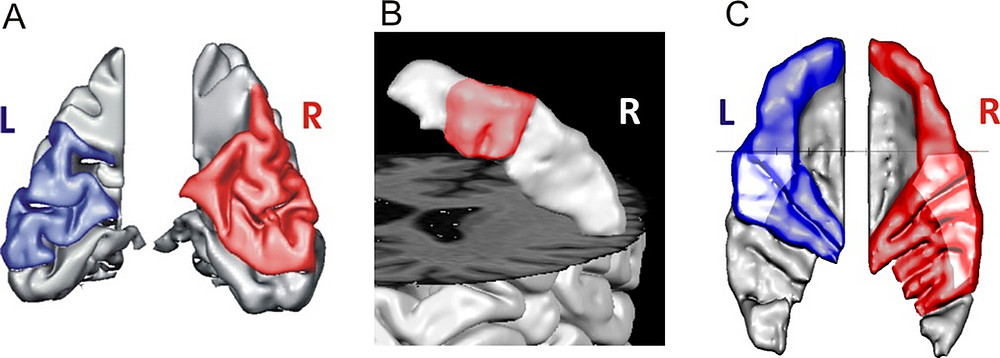
Dies wirft die Frage auf, ob es sich um Einzelfälle handelt oder es typische Konstellationen gibt, bei denen die Merkmale auditorischer, motorischer, sprachlicher, präfrontaler oder/und visueller Areale miteinander korrespondieren. Gibt es übergreifende architektonische bzw. phänotypologische Merkmale im Aufbau des menschlichen Gehirns und - falls ja – in welchem Zusammenhang stehen diese mit speziellen Fähigkeiten, Hochbegabungen oder kognitiven Defiziten? Existieren bestimmte „morphologische Profile“, die auf hohe sprachliche, visuell-räumliche oder numerisch-mathematische Potenziale schließen lassen?
Unsere bisherigen Forschungsergebnisse haben bereits eine neuroanatomische Überlappung musikalischer und sprachlicher Funktionen sowie damit verbundener besonderer Begabungen aufgezeigt. Konkret fanden wir, dass das Volumen an grauer Substanz in der rechten Heschlschen Querwindung sowohl als Neuromarker musikalischer (Seither-Preisler et al., 2014) als auch sprachlicher (Turker et al., 2017) Begabung anzusehen ist. Mehr zum Thema Musik & Sprache finden Sie hier. Ob solche gemeinsamen neurologischen Ressourcen auch für andere kognitive Bereiche existieren, soll Gegenstand künftiger Forschungen sein.
Literatur
Benner, J., Reinhardt, J., Christiner, M., Wengenroth, M., Stippich, C., Schneider, P., & Blatow, M. (2023). Temporal hierarchy of cortical responses reflects core-belt-parabelt organization of auditory cortex in musicians. Cerebral Cortex, 33(11), 7044-7060. https://dx.doi.org/10.1093/cercor/bhad020
Schneider, P., Engelmann, D., Groß, C., Bernhofs, V., Hofmann, E., Christiner, M., […] & Seither-Preisler, A. (2023). Neuroanatomical disposition, natural development, and training-induced plasticity of the human auditory system from childhood to adulthood: a 12-year study in musicians and nonmusicians. Journal of Neuroscience, 43(37), 6430-6446. https://doi.org/10.1523/JNEUROSCI.0274-23.2023
Schneider, P., Groß, C., Bernhofs, V., Christiner, M., Benner, J., Turker, S., […] & Seither‐Preisler, A. (2022). Short‐term plasticity of neuro‐auditory processing induced by musical active listening training. Annals of the New York Academy of Sciences, 1517(1), 176-190. https://doi.org/10.1111/nyas.14899
Zoellner, S., Benner, J., Zeidler, B., Seither‐Preisler, A., Christiner, M., Seitz, A., […] & Schneider, P. (2019). Reduced cortical thickness in Heschl's gyrus as an in vivo marker for human primary auditory cortex. Human brain mapping, 40(4), 1139-1154. https://doi.org/10.1002/hbm.24434
Schneider, P., Benner, J., Zeidler, B., Christiner, M., Seither-Preisler, A., & Engelmann, D. (2018). Audio- und Neuroplastizität der Klangwahrnehmung. Akustik Journal, 2, 16-30. https://www.dega-akustik.de/fileadmin/dega-akustik.de/publikationen/akustik-journal/18-02/akustik_journal_2018_02_online_artikel2.pdf
Benner, J., Wengenroth, M., Reinhardt, J., Stippich, C., Schneider, P., & Blatow, M. (2017). Prevalence and function of Heschl’s gyrus morphotypes in musicians. Brain Structure and Function, 222, 3587-3603. https://doi.org/10.1007/s00429-017-1419-x
Turker, S., Reiterer, S. M., Seither-Preisler, A., & Schneider, P. (2017). “When music speaks”: Auditory cortex morphology as a neuroanatomical marker of language aptitude and musicality. Frontiers in Psychology, 8, 2096. https://doi.org/10.3389/fpsyg.2017.02096
Schneider, P., & Seither-Preisler, A. (2015). AMseL-Neurokognitive Korrelate von JeKi-bezogenem und außerschulischem Musizieren. In U. Kranefeld (Ed.), Instrumentalunterricht in der Grundschule. Prozess- und Wirkungsanalysen zum Programm Jedem Kind ein Instrument (pp. 19-48). BMBF.
Seither-Preisler, A., Parncutt, R., & Schneider, P. (2014). Size and synchronization of auditory cortex promotes musical, literacy, and attentional skills in children. Journal of Neuroscience, 34(33), 10937-10949. https://doi.org/10.1523/jneurosci.5315-13.2014
Wengenroth, M., Blatow, M., Heinecke, A., Reinhardt, J., Stippich, C., Hofmann, E., & Schneider, P. (2014). Increased volume and function of right auditory cortex as a marker for absolute pitch. Cerebral Cortex, 24(5), 1127-1137. https://dx.doi.org/10.1093/cercor/bhs391
Schneider, P., & Wengenroth, M. (2009). The neural basis of individual holistic and spectral sound perception. Contemporary music review, 28(3), 315-328. https://dx.doi.org/10.1080/07494460903404402
Schneider, P., Sluming, V., Roberts, N., Scherg, M., Goebel, R., Specht, H. J., […] & Rupp, A. (2005a). Structural and functional asymmetry of lateral Heschl's gyrus reflects pitch perception preference. Nature Neuroscience, 8(9), 1241-1247. https://doi.org/10.1038/nn1530
Schneider, P., Sluming, V., Roberts, N., Bleeck, S., & Rupp, A. (2005b). Structural, functional, and perceptual differences in Heschl's gyrus and musical instrument preference. Annals of the New York Academy of Sciences, 1060(1), 387-394. https://dx.doi.org/10.1196/annals.1360.033
Schneider, P., Scherg, M., Dosch, H. G., Specht, H. J., Gutschalk, A., & Rupp, A. (2002). Morphology of Heschl's gyrus reflects enhanced activation in the auditory cortex of musicians. Nature Neuroscience, 5(7), 688-694. https://doi.org/10.1038/nn871